Bộ Y tế cùng Bộ Khoa học - Công nghệ vừa tổ chức cuộc họp rà soát các hồ sơ, dữ liệu, kết quả nghiên cứu thử nghiệm lâm sàng và xem xét đề xuất cấp phép khẩn cấp vaccine Nano Covax của Công ty CP sinh học dược Nanogen (Nanogen).
Báo cáo tại cuộc họp, đại diện Nanogen cho hay, đến nay, vaccine Nano Covax đã tiêm thử nghiệm lâm sàng trên 13.620 tình nguyện viên. Trong đó, 60 người thuộc giai đoạn 1, 560 người thuộc giai đoạn 2 và 13.000 người giai đoạn 3. Trong giai đoạn 3, có 1.004 người tiêm đủ 2 liều.
Căn cứ trên dữ liệu nghiên cứu, đánh giá chung, vaccine có an toàn, có tính sinh miễn dịch tốt, nhưng chưa đủ thời gian để đánh giá về hiệu lực (thời gian mà người tiêm có thể được bảo vệ sau khi tiêm đủ liều theo khuyến cáo của nhà sản xuất). Công ty sẽ tiếp tục bổ sung, hoàn thiện hồ sơ sản phẩm, nghiên cứu thử nghiệm tiền lâm sàng và lâm sàng để báo cáo Bộ Y tế vào tuần sau.
Trong khi đó, PGS-TS Lê Văn Truyền, Chủ tịch Hội đồng Tư vấn cấp giấy đăng ký thuốc, nguyên liệu làm thuốc khẳng định Hội đồng rất ủng hộ việc nghiên cứu phát triển vaccine trong nước. Tuy nhiên, hồ sơ xin cấp phép vaccine trong điều kiện khẩn cấp phải đảm bảo tính khoa học và pháp lý.
Kết luận cuộc họp, Thứ trưởng Bộ Y tế Trần Văn Thuấn khẳng định, về chủ trương, Bộ Y tế, Hội đồng Đạo đức trong nghiên cứu y sinh học quốc gia và Hội đồng Tư vấn cấp giấy đăng ký thuốc, nguyên liệu làm thuốc luôn ủng hộ, tạo điều kiện cho Nanogen cũng như các công ty, đơn vị trong nước trong việc nghiên cứu, phát triển và sản xuất vaccine phòng Covid-19, với mong muốn sớm nhất có vaccine “Made in Vietnam” để chủ động nguồn cung vaccine trong phòng, chống dịch bệnh Covid-19.
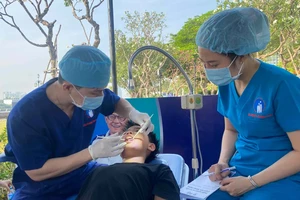
 Tiêm thử nghiệm lâm sàng vaccine Nano Covax tại Học viện Quân y. Ảnh: VIẾT CHUNG
Tiêm thử nghiệm lâm sàng vaccine Nano Covax tại Học viện Quân y. Ảnh: VIẾT CHUNG Về điều kiện để cấp phép khẩn cấp, Thứ trưởng đề nghị Nanogen phải phối hợp chặt chẽ với Cục Khoa học Công nghệ và Đào tạo, Bộ Y tế và các đơn vị nghiên cứu, các nhà khoa học hoàn thiện hồ sơ kết quả nghiên cứu pha 1, pha 2 và khẩn trương có được kết quả giai đoạn đầu của pha 3 (3A).
Dựa trên hồ sơ, số liệu đánh giá tổng kết này, Thứ trưởng đề nghị các nhà khoa học, các chuyên gia của Hội đồng đạo đức trong nghiên cứu y sinh học Quốc gia, Hội đồng tư vấn cấp giấy đăng ký thuốc, nguyên liệu làm thuốc sớm xem xét đề xuất cấp phép khẩn cấp đối với vaccine Nanocovax khi kết quả cho thấy an toàn, hiệu quả, chặt chẽ, khoa học… Trên cơ sở những kết quả thử nghiệm lâm sàng đã có, ý kiến của các thành viên của 2 Hội đồng, ý kiến các chuyên gia trong và ngoài nước, tình hình dịch bệnh và nhu cầu vaccine phục vụ phòng, chống dịch, Bộ Y tế sẽ nghiên cứu, xem xét việc cấp phép lưu hành khẩn cấp đối với vaccine Nanocovax.
| Ngày 23-7, AstraZeneca đã chuyển về TPHCM thêm 1.228.500 liều vaccine Covid-19. Đây là lần giao vaccine thứ 5 và cũng là lượng vaccine lớn nhất từ trước đến nay thuộc hợp đồng đặt mua trước giữa AstraZeneca Việt Nam và Công ty VNVC, dưới sự hỗ trợ của Bộ Y tế. Hiện, hợp đồng này đã mang về cho Việt Nam hơn 3,1 triệu liều, tương đương với khoảng 37% tổng lượng vaccine Covid-19 của AstraZeneca trong nước. Số còn lại đến từ Cơ chế COVAX và viện trợ song phương giữa chính phủ các nước. |